近日,我校医学部周庆华课题组在Nature Communications上发表了题为Histone H3K4me3 modification is a transgenerational epigenetic signal for lipid metabolism in Caenorhabditis elegans的研究成果,报道了高脂食物喂养可诱导线虫的脂肪积累表型,且父母代线虫可将这种肥胖信号传递给后代,导致后代在没有高脂喂养的情况下,也可表现出脂肪积累表型,并揭示了这种跨代遗传效应被组蛋白H3K4me3的修饰所介导。

表观遗传是指在基因的核苷酸序列没有发生改变的情况下,基因表达发生了可遗传的变化,并最终导致了表型的变化。同一个体中不同组织之间或不同个体之间,表观遗传修饰的差异可能导致基因表达的改变,进而在核苷酸序列不变的情况下导致表型差异。表观遗传既能影响同一个体不同发育阶段的基因表达的变化,也可以通过生殖细胞将信息跨代遗传给下一代甚至数代,即跨代表观遗传。多种环境经历,如饥饿、饮食、药物、温度刺激、病原体刺激等,对机体产生的影响均可产生跨代表观遗传。
达尔文进化论认为:物种的突变是随机的,更适应环境的突变体存在更大的生存优势,从而形成物种的演化。然而,历史上,在达尔文的进化论提出之前,拉马克曾经提出“获得性遗传”的理论,认为上一代环境因素对个体的影响可能遗传到下一代。这种“获得性遗传”曾经被当作“进化论”的对立面,遭到质疑和批判。但随着技术手段的进步和更多研究的开展,越来越多的案例表明,在核苷酸序列没有变化的情况下,性状遗传给了下一代,也就是观察到“获得性遗传”或者“跨代遗传”现象。目前最新研究显示,生物体不仅有作为遗传物质的基因组信息,还有一套管理、调控、修饰基因组的密码指令系统,即表观遗传印记(表观的意思就是在遗传物质之上的调控)。不同的个体在不同环境下,这套指令系统会针对外界条件作出相应的反应,进而改变个体的适应性。
研究显示,表观遗传的印记在没有遭受环境压力的数代之后,可能会渐渐丢失。这表明,以DNA为载体的中心法则仍是传递遗传信息的主要方式,而表观遗传可作为它重要的有益补充,两者不存在非此即彼的绝对对立矛盾。事实上,执行表观遗传修饰的这一整套系统,本身就是被基因组所控制的,故它的存在并不违背进化论原则。
近来,很多研究发现,营养过剩导致的肥胖可以通过表观修饰来进行跨代传递。喂食高糖饮食的肥胖雄性果蝇可通过组蛋白甲基化修饰将脂质积累信息跨代传递给后代,并诱导后代肥胖表型;喂食高脂饮食的肥胖小鼠可通过精子的miRNA的变化和生殖细胞DNA甲基化,将脂质积累信息传递给他们的后代并导致其肥胖。然而,脂质积累诱导的跨代表观遗传的具体分子机制,仍未被完全阐明。
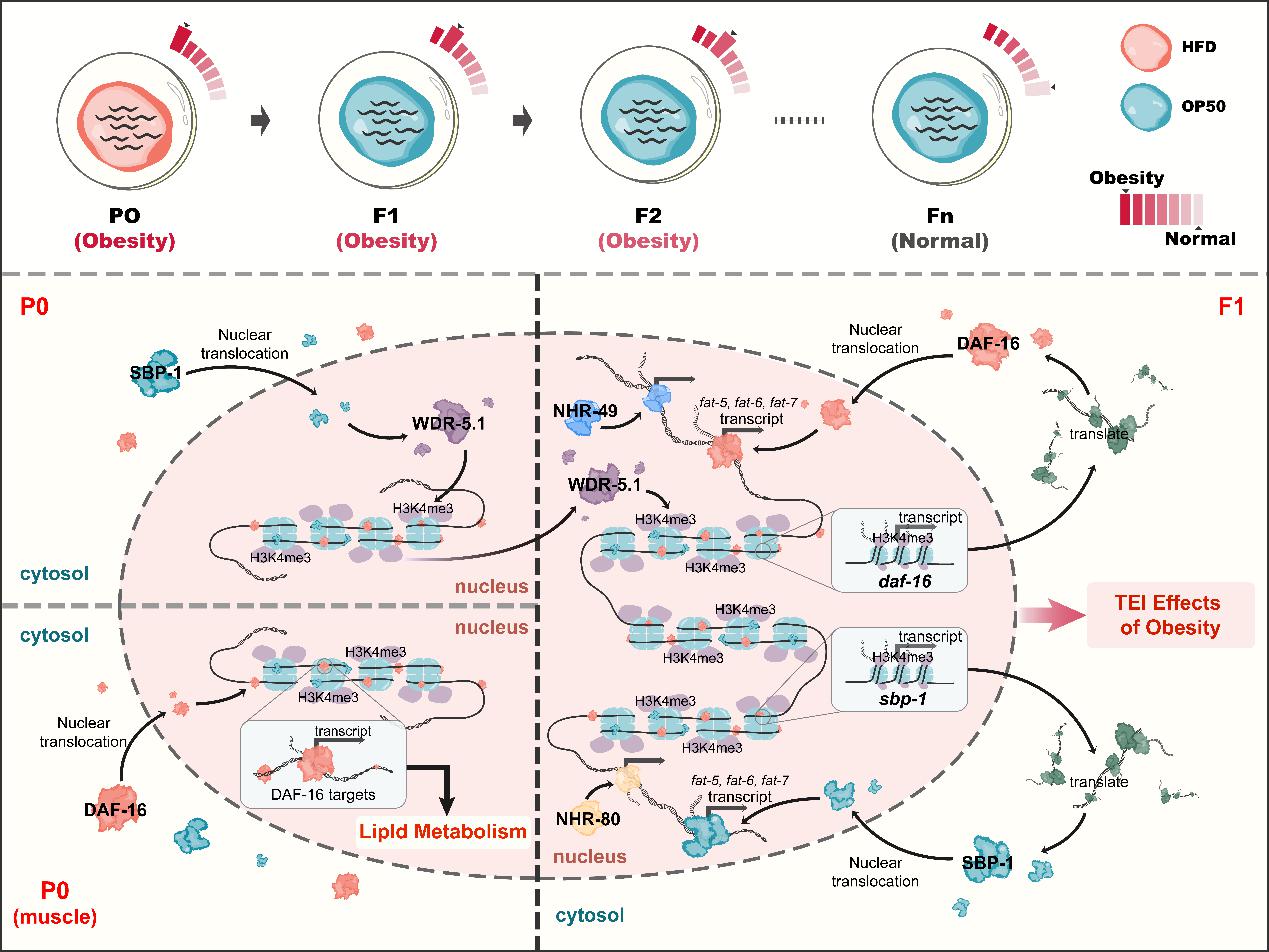
在周庆华团队的研究中,作者发现转录因子DAF-16/FOXO和SBP-1/SREBP,核受体NHR-49和NHR-80,delta-9去饱和酶(FAT-5、FAT-6和FAT-7),以及WDR-5.1参与的H3K4me3介导了跨代脂质积累。
为进一步解析这些参与脂质积累跨代遗传的分子在整个过程中是执行脂代谢相关应答反应,或是传递脂质积累信息,还是同时参与两者,作者设计了代次特异性RNAi沉默(即通过亲代P0或者子代F1代特异地RNAi沉默)实验进行深入解析,并发现在这些因子中,NHR-49,NHR-80和delta-9去饱和酶(FAT-5、FAT-6和FAT-7)作为参与脂代谢调控的执行者,WDR-5.1是跨代信息的传递者,而DAF-16和SBP-1既是执行者也是传递者。
总之,在这项研究中,作者发现通过高脂食物喂养线虫会导致脂质的积累,且亲代中脂质积累的压力会诱导脂质代谢相关转录因子及核受体SBP-1、DAF-16、NHR-49和NHR-80的活性。同时,SBP-1调控组蛋白H3K4me3修饰,并在后代中建立表观遗传标记。反过来,子代中的H3K4me3标记促进脂质代谢相关基因(如sbp-1和daf-16)的募集并促进它们的激活;同时,DAF-16和SBP-1的激活能招募NHR-49或NHR-80形成复合物,然后DAF-16、SBP-1、NHR-49和NHR-80协同诱导脂质代谢调控相关基因(如fat-5、fat-6和fat-7)的表达去响应脂质代谢变化并重置代谢过程,最终实现肥胖效应的跨代表观遗传(下图)。
暨南大学医学部周庆华教授为本研究的通讯作者,医学部万钦黎副教授(课题组出站博士后)和暨南大学硕士毕业研究生孟晓为该论文的共同第一作者。原文链接:https://doi.org/10.1038/s41467-022-28469-4。
在另一项发表在Science Advances上的平行研究中,周庆华团队利用秀丽隐杆线虫为模型,发现轻度的热激会导致线虫的寿命延长,且这种现象在未经热激的后代中仍然能维持到F5代。深入机制研究中,作者揭示在高温刺激的环境压力下,亲代的热应激会激活DAF-16,HSF-1和DAF-12来延长寿命,而其中DAF-16还调控N6-mA和H3K9me3的水平并在后代中建立这些表观遗传标记。反过来,子代中的H3K9me3和N6-mA标记会促进应激反应相关基因(即daf-16,hsf-1和daf-12,daf-16和hsf-1的靶基因)的募集并促进热应激反应的激活,最终导致由热应激介导的生存优势的跨代表观遗传(Wan Qin-Li, et al., Science Advances, 2021)。
这两项研究得到国家自然科学基金项目、国家科技部项目和广东省自然科学基金项目的资助。


